[2023 여름 자몽 시리즈] 04. 앤서니 하이만
자연과학대학 홍보기자단 자:몽 4기 | 김예은
6기 | 박준섭
생체막 없이도 생체분자들이 스스로 조직되는 원리를 물리학적으로 규명하고, 나아가 형성된 생체분자 응집체의 생물학적인 중요성을 시사한 앤서니 하이만에게 상큼한 자몽상을 수여합니다!

그림 1. 앤서니 하이만의 사진. (사진=Group Leader: MPI-CBG 홈페이지(자료1))
자몽이 바라본 노벨상
과학은 관찰하고 검증하는 학문이다. 지속적인 고민과 검증의 결과로 밝혀낸 규칙은 현상을 기술하는 전형적인 지식 체계, 패러다임으로 귀속된다. 철학자 토마스 쿤(Thomas S. Kuhn)이 《과학혁명의 구조(The Structure of Scientific Revolutions)》(자료2)에서 처음 제시한 개념인 과학적 패러다임은 한 시대의 과학자 공동체가 공유하는 전형적인 탐구 주제를 제공하는 보편적인 과학적 성과이다. 패러다임을 구성하는 각 분야의 전형은 현상과 관점의 보완을 통해 설명된다. 따라서 누군가 기존의 정상과학에 포함되지 않는 현상을 발견하거나, 적체된 특이점을 수용할 수 있는 관점을 제시한다면, 인류의 지식 체계를 확장하고 패러다임의 전환에 공헌했다는 수월성을 인정받을 자격이 충분하다.
그리하여 이 기사에서는 노벨상 수상 분야의 경계에서 획기적인 현상뿐 아니라 관점을 함께 제시하여 새로운 패러다임을 제공한 학제적 접근을 인류를 위한 큰 헌신으로 해석했다. 그간 노벨상 시상은 새로이 발견된 현상과, 그 현상의 혁신적인 응용에 주로 치중되었다. 일례로 아인슈타인(Albert Einstein)의 상대성이론이 번번히 수상에 실패한 이유 또한 시공간을 바라보는 색다른 관점의 제시가 실험적인 증거보다 선행되었기 때문이라는 해석이 존재한다. 또한, 최근 이론과학의 관점을 이용하여 전통적인 대상뿐 아니라 복잡성이 높은 계에서의 현상을 해석하려는 연구 동향이 짙어졌다(자료3). 따라서 물리학과 생물학이라는 서로 다른 학문의 경계에서 새로운 연구 분야의 지평을 여는 방법론을 제시한 연구도 과학계와 인류를 향한 큰 헌신임에 틀림없다.
자전거광의 세포 정비 여정
영국의 시골 지역인 데본(Devon)에서 자란 앤서니 하이만(Anthony A. Hyman)은 어린 시절 여느 어린아이들처럼 자전거와 자동차를 좋아했다. 하이만이 엔진을 분해해 놓은 탓에 그의 아버지가 주말에 운전을 나가지 못한 적도 있었다고 한다. 고등학생이 된 이후에는 생물학에 관심이 생겨 의사의 꿈을 품었지만 성적이 부족해 대학에 진학하지 못했고, 대신 연구실에 기술자로 취직하였다. 생물연구실에서 일하는 동안 그는 친구와 함께 자전거 가게를 차려 정비공이 되는 꿈을 꾸기도 했다. 하지만 연구실에서 생물학을 계속해서 접하다 보니 다시금 생물학자의 꿈이 생겼고 연구를 계속하지 않겠냐는 교수님의 제안에 본격적으로 과학자의 길을 걷게 된다(자료4).
그렇게 UCL(University College London)의 생물학과에서 학사 학위를 취득한 이후, 박사 학위를 위해 케임브리지 대학의 John White 연구실을 선택한다. 세포의 구조와 기계적 특성을 다루는 John White의 연구가 생물학과 기계를 모두 좋아하는 자신의 성향과 잘 맞다고 생각했기 때문이다. 그는 예쁜꼬마선충의 초기 배아 분열 단계에서 분열 축(division axes)이 확립될 때 미세소관이 수행하는 기계적인 역할을 밝혀내는 연구를 통해 박사 학위를 받았다. 이후 연구 분야를 점차 늘려 나가며 1999년부터는 막스플랑크 분자 생물학 및 유전학 연구소의 설립 이사로 활동하게 된다.
*분열 축(division axes): 세포가 분열하는 과정에서 형성되는 경계선
*미세소관: 세포가 골격을 유지할 수 있게 돕는 구조 단백질의 일종
이후 2009년에는 그의 연구 분야와 분자생물학의 연구 동향을 동시에 뒤바꿔버리는 중대한 발견이 이루어진다. 예쁜꼬마선충의 배아 세포에 존재하는 P 과립(P granule)이 생체막 없이 액체 형태로 뭉친 덩어리로 존재함을 발견했는데, 이는 세포 내에서 지금까지 한 번도 발견된 적 없는 획기적인 현상이었다. 이때의 발견에서 비롯된 상분리 연구를 바탕으로 그는 상분리 분야의 세계적인 대가로 거듭났고, 2023년 생명과학 분야의 Breakthrough상 수상의 영예 또한 거머쥘 수 있었다.
*P과립(P granule): 예쁜꼬마선충의 핵 주변부 RNA 및 RNA 결합 단백질로 이루어진 과립
*Breakthrough상: Google의 창립자 세르게이 브린(Sergey Brin), Facebook의 창립자 마크 저커버그(Mark Zuckerberg) 등이 설립한 재단에서 수여하는 큰 과학적 진보를 이룬 과학자에게 주는 국제적인 상
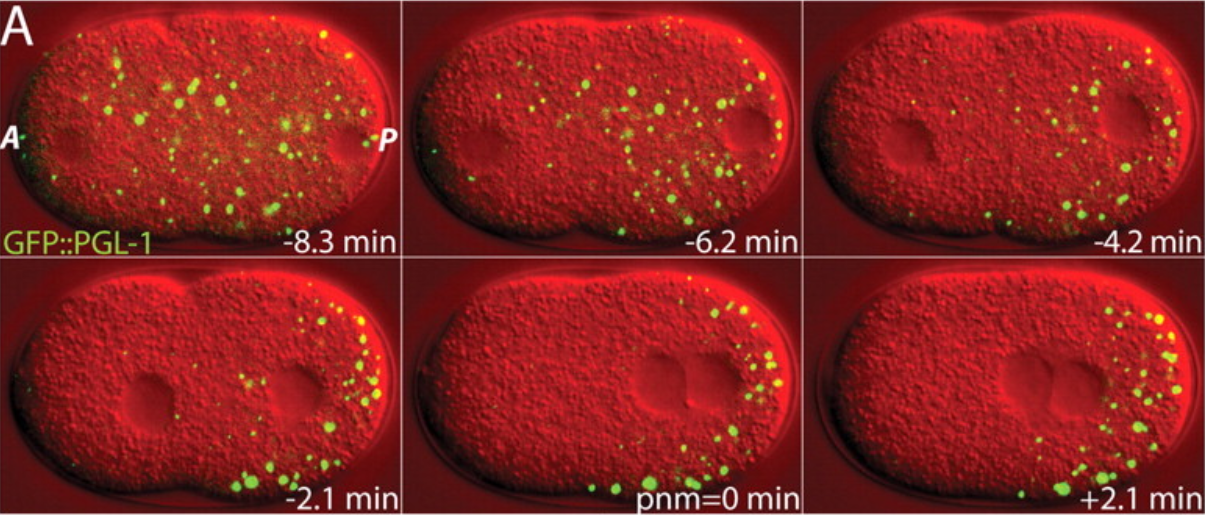
그림 2. 형광 현미경으로 관측한 P과립의 유동. (사진=Science Vol 324, Issue 5935, pp. 1729-1732 (2009) (자료5))
상분리를 통해 세포 내 구획의 새로운 기작을 제시하고 생체분자 응집체의 무한한 가능성을 발견한 앤서니 하이만
세포 내에는 핵산, 단백질 등의 여러 생체분자가 존재하고, 이들을 주역으로 하여 여러 생명활동이 일어난다. 이들 생체분자는 혼자 행동하지 않는다. ‘몸으로 말해요’ 게임처럼, 분자 1은 분자 2를, 분자 2는 분자 3을 툭툭 건드리며 일련의 상호작용이 발생한다. 이러한 순차적인 흐름을 ‘캐스케이드(cascade)’라 부른다. 하나의 작은 세포 안에는 캐스케이드 수백만, 수천만 개가 먹이그물처럼 복잡하게 얽혀있고, 한 캐스케이드의 주역이었던 분자가 다른 캐스케이드의 조연이 되기도 한다. ‘생체막’은 이렇게 복잡한 그물망이 꼬여서 충돌하지 않을 수 있도록 질서를 유지시켜주는 데 큰 기여를 한다. 또한 세포 내 대부분의 세포소기관은 생체막으로 둘러싸여 있다. 그런데 하이만은 연구를 통해 생체막으로 둘러싸이지 않은 채로 생체분자끼리 스스로 응집된 덩어리 역시 여러 주요한 생명 현상에 관여함을 밝혀냈다. 1830년대, 신경세포의 핵에서 막이 없는 응집체가 처음 발견되었고, 이것이 바로 인(nucleolus)이다. 이렇게 막 없이도 세포 내에서 구획을 이루는 생체분자들의 덩어리를 하이만은 ‘생체분자 응집체(biomolecular condensates)’라 명명하였고, 생체분자들이 스스로 뭉쳐 다양한 생화학적 기능을 수행하는 원리를 물리학적으로 규명하는 데에 주력하였다. 이후 핵뿐만 아니라 세포질에서도 막이 없는 생체분자 응집체가 발견되기 시작했고, 앤서니 하이만 연구소에서는 이러한 생체분자 응집물 연구에 박차를 가했다.
하이만이 상분리 개념을 통해 생명 현상을 바라보게끔 인도한 가장 결정적인 연구는 예쁜꼬마선충의 P 과립 관측이었다. P 과립은 예쁜꼬마선충의 생식 세포 내에 존재하는 단백질과 RNA이 섞인 생체분자 덩어리이다. 첫 번째 세포분열 과정에서 P 과립이 비대칭적으로 분리되다가도 여러 액체 방울이 하나로 합쳐지는 것처럼 응축되며, 세포질과 독립적으로 이동하는 현상이 관찰되었다. 마치 물 위에 동동 떠다니는 기름 방울과 비슷한 형상이다. 이러한 P과립의 독특한 유동으로부터 물리학에서의 상분리 현상을 이용해 생명 현상을 분석할 가능성이 발견됐다. P 과립의 움직임을 물 위의 기름방울들이 합쳐지는 것처럼, 서로 잘 결합하는 생체분자들끼리 뭉쳐 액체 속에서 액체 방울을 형성하는 액체-액체 상분리 현상으로 해석할 수 있기 때문이다. 이것으로 세포의 분열 과정에서 응집되어 AP 축의 한쪽에만 비대칭적으로 P과립 응집체가 형성되는 관측 결과를 설명할 수 있었다. P 과립의 연구 이후로 핵소체(nucleoli), DNA 손상 복구 영역(DNA damage repair site), 스트레스 과립(stress granule) 등의 다른 응집체들도 액체 방울과 비슷한 특성을 가지는 것이 밝혀졌다. 이는 각각의 생화학적 기능을 수행하는 세포 내의 여러 구획이 막이 없는 생체분자들이 상분리를 통해 응집되어 조직되었을 수 있음을 시사하는 중대한 발견이었다.
*예쁜꼬마선충: 투명하고 대략 1 mm 정도의 몸 길이를 지닌 선충의 일종으로 주로 썩은 식물체 주위에서 서식하고 다양한 생물학 연구에서 활발하게 이용되는 생명체 중 하나
*AP 축(anterior-porsterior axis): 배아의 발생 과정에서 나타나는 전후 방향으로 뻗은 가상의 축
응집된 생체분자들은 응집체 내부에서 활발하게 상호작용하고, 응집체의 경계면은 응집체 바깥의 주변과도 활발히 상호작용할 수 있는 구조이다. 일반적인 막성 세포소기관 내의 생체분자들은 세포막을 통과해야 하는 절차를 거쳐야하는 반면, 막이 존재하지 않는 응집체의 경계면은 더 간편하게 통과할 수 있기 때문이다. 따라서 막성 세포소기관과 생분자성 응집물 각각은 다른 존재 의의가 있는 것이다. 생체막은 더 지속력이 긴, 길어야 하는 캐스케이드와 부속 효과를 유지하고, 이온 등 전하를 띠는 생체분자의 상호작용에 유리하다. 반면 상분리를 통해 막 없이 뭉쳐진 생체분자 응집물은 더 단발적이고, 빠르게 일어나야 하는 상호작용에 있어 이득이 있다. 막 없이 어디서든 응집될 수 있으므로 주위 액체의 완충 작용이나 특정 화학 반응의 조절, 세포막 부근에서의 힘 유지 등의 다양한 용도로 보다 유연하게 활용될 수도 있다.
여기까지 상분리 현상의 생명체 내 역할을 처음 접하고나면 다음과 같은 의문점이 생길 수 있다. 응축물의 표면에서 주위 액체와 응축된 생체분자들 사이에 농도 차이가 존재한다면 어떻게 뭉친 생체분자들이 다시 주위로 확산되지 않을까? 온도와 압력이 엇비슷하게 유지되는 환경에서 화학 반응은 자유 에너지가 낮아지는 쪽으로 일어난다. 자유 에너지를 결정하는 두 요소는 엔탈피와 엔트로피로 엔탈피가 커질수록, 또 엔트로피가 낮아질수록 자유 에너지는 높아진다. 즉, 두 물리량은 생체분자들이 서로 뭉치는 것과 같은 특정 반응의 여부를 결정할 때 서로 경쟁하는 관계에 있다. 엔탈피는 얼마나 화학 반응을 위한 상호작용이 강력한지에 따라 달라지고, 엔트로피는 반응이 일어난 상태에서 분자들이 얼마나 많은 경우의 수로 존재할 수 있는지에 의존한다. 따라서 물에 색소를 풀어놓았을 때 색소 분자들이 퍼지는 현상은 색소 분자가 퍼질수록 자유롭게 움직이며 같은 엔탈피 상태에서 더 많은 경우의 수로 존재할 수 있으므로 엔트로피가 높아지기 때문에 일어난다고 이해할 수 있다. 그렇다면 생체분자들이 더 엔트로피가 낮은 상태임에도 불구하고 응집체를 형성하는 비결은 무엇일까?
주위 농도와의 차이를 이겨내려고 생체분자들이 서로 결합력을 유지하기 위해서는 여러 분자 차원에서의 방법이 동원될 수 있다. 그중 가장 대표적인 방법은 생체분자들끼리 서로 더 많은 손을 맞잡아 더욱 끈끈하게 뭉치는 것이다. 강력한 상호작용으로 손을 맞잡은 분자들의 결합을 끊어내기 위해 많은 에너지가 필요하기 때문에, 반대로 여러 결합 부위를 통해 단단하게 결합할 수 있다면 더욱 낮은 에너지 상태로 내려가기 쉽다는 뜻이 된다. 실제로 생체분자 응집체는 상당수가 다중결합을 하는 분자들(multivalent molecule)로 구성된다. 단백질은 여러 개의 결합 부위를 가져서 분자 사이의 상호작용을 늘릴 수 있고, DNA처럼 한 분자의 길이가 긴 경우 분자 내의 상호작용 또한 단백질과의 교차 연결(cross linking)을 통해 상분리에 가담할 수 있다. 이렇게 생체분자 응집체를 분자 사이의 상호작용 차이 덕분에 형성된 중합체(polymer)로 인식하면, 중합체와 용매 사이의 상호작용에 의한 에너지를 고려한 Flory-Huggins 변수 등을 도입해서 물리학적인 관점에서 생체분자 응집체의 형성을 예측할 수 있다.
생체분자 응집체의 원리를 이용한 질병 치료 연구
상분리를 처음 접한다면, 생체분자 응집체의 중요성이 잘 와닿지 않을 수 있다. 막도 없이 단순히 뭉쳐진 액체 방울이 어떤 역할을 한다는 말인가. ‘패러다임’이라 불릴 만한, 학계의 주류를 꿰찬 새로운 지식이라면 우리의 삶과 가까운 사회적 의의 또한 있어야 한다.
액체-액체 상분리(이하 LLPS; Liquid-Liquid Phase Separation)는 단백질이 응집되도록 하는데, 이는 질병과도 이어질 수 있다. 체내의 단백질은 수용성으로, 3차 구조로 잘 접혀있을 때 본연의 기능을 잘 수행할 수 있다. 그러나 비정형 단백질(intrinsically disordered protein)이라고 불리는 일부 단백질은 아미노산 배열이 3차 구조를 제대로 형성하지 않아, 비정상적으로 접혀 뭉쳐진다. 이를 애그리게이션(aggregation)이라 한다. 애그리게이션된 단백질은 제대로된 기능을 수행할 수 없으므로, 이를 잘 풀어줄 수 있는 과정(deaggregation)이 필요하다. 그러나 대사증후군을 앓는 환자나, 단백질이 더 잘 뭉치게 하는 돌연변이가 있는 경우 디애그리게이션 과정이 잘 수행되지 않고 이는 질병으로 이어진다. 가장 잘 알려진 예시는 신경퇴행성 질환이다. 신경퇴행성 질환의 대표주자인 알츠하이머는 아밀로이드(amyloid), 타우(tau) 등의 단백질이 잘못 접혀 형성으로 인해 초래되는 질병이다. 이러한 단백질은 일반적으로 액체-액체 상으로 분리되어 있지만, 질병을 앓는 환자의 경우 액체-고체와 같은 상으로 분리된다는 것이다. 예를 들어 상분리 직후 RNA와 단백질이 잘 응집되어 액체 상을 형성하다가, 어느순간 상이 불안정해지고, 이를 다시 안정화하기 위해 액체를 밀어내고 단백질끼리 응집하면서 섬유화되는 현상이 신경퇴행성 질환에서 많이 발견된다.
신경퇴행성 질환을 치료하는 방법은 꽤 까다롭다. 단순히 문제가 되는 단백질을 제거하거나 활성을 멈추게 하는 방법으로 질병을 치료할 수 없기 때문이다. TDP-43 단백질은 잘못 접힐 경우 루게릭병의 원인이 된다. 이 단백질은 RNA의 대사와 전사를 조절하는 단백질로, 신경세포의 생존에 있어 필수적인 단백질이다. 따라서 mRNA를 분해시키는 유전자 침묵(gene silencing) 약물을 처리하여 치료를 진행하기 어렵다. TDP-43을 제거하게 되면 신경세포의 기능이 멈추기 때문이다.
이와 같은 상황에서, 상분리에 관한 연구가 활발히 진행됨에 따라 LLPS를 표적으로 하여 신경퇴행성 질환을 치료하자는 아이디어가 새롭게 제시되었다. 이러한 접근법은 TDP-43의 응집을 막으면서도, 신경세포의 생리학적 기능은 유지할 수 있게 한다. LLPS를 억제하는 첫 번째 방법으로, TDP-43처럼 RNA에 결합하는 단백질 중 하나인 Ataxin2의 제거가 있다. Ataxin2는 TDP-43과 마찬가지로 RNA와 응집되어 상분리를 하는 단백질이다. 핵의 중요한 기능을 담당하는 TDP-43과 달리, Ataxin2는 세포의 활성에 큰 영향을 미치지 않기에 유전자 침묵 약물을 사용할 수 있다. Ataxin2의 감소는 TDP-43의 응집을 저해시키는 효과를 가져온다.
한편 TDP-43의 상분리 상태를 유지시켜 응집을 막는 방법도 있다. TDP-43이 액체 상에서 섬유화되도록 변화를 유도하는 기작 중 하나는 전사 후 조절(post translational modification)이다. 전사 후 조절을 매개하는 효소를 표적으로 하여 응집을 저해할 수 있다. 예컨대 섬유화를 촉진하는 메틸레이션(methylation) 효소는 제거하고, 섬유화를 완화하는 아세틸레이션(acetylation) 효소는 촉진함으로써 상분리 상태를 유지하도록 유도할 수 있다.
*아세틸레이션(acetylation): 화합물에 아세틸기(CH₃CO)를 붙이는 것
*메틸레이션(methylation): 화합물에 메틸기(CH₃)를 붙이는 것. 혹은 그로 인해 원자가 치환되는 현상
이처럼 기존의 치료법을 적용할 수 없는 질병들에 대해서, 상분리로 접근해 단백질 고유의 기능을 해치지 않음과 동시에 근본적인 단백질 접힘 문제에 접근해 해결한다는 점에서 상분리를 통한 생체분자 중합체의 주목할만한 의의 중 하나가 여실히 드러난다.

그림 3. 자전거를 타며 여가 생활을 즐기는 하이만의 모습. (사진=JCB 79(7): pp. 1330–1331 (2007) 왕립학회 인터뷰(자료4))
네 번째 자몽상의 주인공, 앤서니 하이만
생체막이 없이도 스스로 응집된 생체분자들의 관점에서 다양한 생명 현상의 기작을 이해하기 위해 물리학의 개념을 이용한 하이만의 연구는 앞서 이 기사에서 제시한 두 가지 수상 기준을 잘 만족한다고 볼 수 있다. 하이만에게 Breakthrough상의 영광을 안겨준 생명체 내에서의 상분리 연구의 가치는 P 과립이나 생체분자 응축물의 발견 자체로 전부 설명할 수 없다. 관측한 현상을 어떠한 방법과 관점을 동원하여 해석할 것인지를 선택하는 과학적 성취의 과정에서 하이만은 생체분자 응집체의 조직 원리를 규명해내기 위해 물리학의 아이디어를 동원했고, 기존의 생체막을 바탕으로 한 세포소기관 패러다임을 효과적으로 전환하는 데에 성공했다. 나아가 생체분자 응집체가 세포의 물질대사에 필요한 다양한 기작뿐 아니라 후성유전학적인 전사 조절의 근간이 되는 염색질 조직화에도 기여함이 알려졌다. 결과적으로 생체분자들의 막이 없는 액체 방울로의 상분리가 분자생물학자들이 세포 내의 생명 현상을 이해하는 근본적인 사고 방식을 바꿔어놨다고 해도 과언이 아니다. 이에 자몽은 생물학과 물리학의 경계에서 상분리를 통해 분자생물학계에 새로운 패러다임과 무수한 지식 체계 확장의 발판을 제공한 하이만에게 자몽상을 수여한다.
하이만은 요즘도 자전거를 타며 여가 시간을 보내곤 한다. 학창 시절 A 등급을 충분히 받지 못해 연구실 기술자부터 학자로서의 진로를 시작했던 그는 왕립학회 회원이 된 이후 인터뷰에서 성적에만 의존해서 과학자를 선발하고 양성하는 현 세태에 회의감을 드러냈다. 현재는 유명 재즈 베이스 기타리스트가 된 친구와 함께 자전거 가게 창업을 계획했던 과거의 꿈도, 생물학을 향한 열정을 담아 분자생물학계의 패러다임을 전환해낸 현재의 성공적인 성과도 모두 여유롭지만 우직하게 쫓아가고 있는 그의 모습은 상분리와도 닮았다. 당장은 기존의 주류와 달리 생체막이 없어 기능을 짐작하기도, 지속력을 가늠하기도 힘들지 모른다. 하지만 내면의 강한 열정과의 상호작용을 일궈낼 수 있다면 막 없이도 올곧게 응집하여 제 기능을 다하는 생체분자들처럼 원하는 꿈을 피워낼 수 있을 것이다.
[자료]
[1] Hyman, A. A. Group Leader: MPI-CBG. Max Planck Institute of Molecular Cell Biology and Genetics, https://www.mpi-cbg.de/research/researchgroups/currentgroups/anthony-hyman/group-leader. Accessed 24 July 2023.
[2] Kuhn, Thomas S. The Structure of Scientific Revolutions. University of Chicago Press, 3rd ed. 1996.
[3] 최무영. 복잡계란 무엇인가. 프레시안, https://www.pressian.com/pages/articles/56531. Accessed 24 July 2023.
[4] Williams, Ruth. Anthony Hyman: From unlikely scientist to Royal Society Fellow. J Cell Biol. 179(7): pp. 1330–1331. 2007.
[5] Brangwynne, Clifford P. et al. Germline P Granules Are Liquid Droplets That Localize by Controlled Dissolution/Condensation. Science 324(5935): pp. 1729-1732. 2009.
[참고 문헌]
[1] Hyman, A. A., Weber, Christoph A. & Jülicher, Frank. Liquid-Liquid Phase Separation in Biology. Annual Review of Cell and Developmental Biology 30: pp. 39-58. 2014.
[2] Banani, Salman F. et al. Biomolecular condensates: organizers of cellular biochemistry. Nature Reviews Molecular Cell Biology 18: pp. 285–298. 2017.
[3] Yeo, S. J., Ying, C., Fullwood, M. J. & Tergaonkar, V. Emerging regulatory mechanisms of noncoding RNAs in topologically associating domains. Trends Genet. 39: pp. 217-232. 2023.
[4] Shakya, A., Park, S., Rana, N. & King, J. T. Liquid–liquid phase separation of histone proteins in cells: role in chromatin organization. Biophys. J. 118, pp. 753–764. 2020.
[5] Larson, A. G. et al. Liquid droplet formation by HP1α suggests a role for phase separation in hetero-chromatin. Nature 547: pp. 236–240. 2017.
[6] Strom, A. R., Emelyanov, A. V., Karpen, G. H. Phase separation drives heterochromatin domain formation. Nature 547: pp. 241–245, 2017.
[7] King, J. T., Shakya, A. Phase separation of DNA: From past to present. Biophys. J. 120: pp. 1139-1149. 2021.
[8] 신용대. 세포 안의 액체 방울: 상분리에 의한 세포 구획화. KSMCB 2020년 9월호 Webzine, https://www.ksmcb.or.kr/webzine/2009/content/research_01.html. Accessed 25 July 2023.
*기사 작성에 도움을 주신 류제경 교수님께 감사의 말씀 드립니다.
자연과학대학 홍보기자단 자:몽 김예은 기자 ysilverk1@snu.ac.kr
박준섭 기자 sseobyi6410@snu.ac.kr
카드뉴스는 자:몽 인스타그램 @grapefruit_snucns 에서 확인할 수 있습니다.



