떠오르는 신약 플랫폼, 표적 단백질 분해 기술 (targeted protein degradation (TPD) technologies)
떠오르는 신약 플랫폼, 표적 단백질 분해 기술
(targeted protein degradation(TPD) technologies)
자연대 홍보기자단 자:몽 5기 | 김민서
한 번쯤 에이즈(AIDS)의 치료제 중 하나인 리토나비르(Ritonavir), 그리고 코로나19치료제인 팍스로비드(Paxlovid)의 성분인 니르마트렐비르(Nirmatrelvir)와 같은 약물들을 들어본 적이 있을 것이다. 이 두 약물은 모두 에이즈와 코로나19를 일으키는 HIV와 SARS-CoV-2의 단백질 분해효소(protease)를 억제하는 역할을 한다는 공통점이 있다. 이 두 약물 이외에도 질병 치료에 많이 사용되는 약물들은 질병을 일으키는 표적 단백질에 붙어 그 단백질의 활성이나 기능을 억제하는 저해제(inhibitor) 역할을 하고 있다. 이러한 표적치료제들은 질병의 원인이 되는 단백질에만 붙어 작용하기 때문에 몸 전체에 무작위적으로 작용하는 약물에 비해 부작용이 적다는 장점이 있어 신약 개발에서 많은 주목을 받아왔고, 또 이를 기반으로 한 많은 약물들이 등장하였다.
그러나 이러한 기존의 표적치료제들에게도 한계점은 존재했다. 먼저 표적단백질에서 약물이 결합하는 부위에 변이가 생겨 약물이 제대로 작용하지 못하게 된다는 점과 표적치료제가 시간이 지남에 따라 우리 몸에서 제거되면서 약효가 미미해진다는 점이 문제였다. 또한 상대적으로 고농도의 약물을 사용해야 하므로 이로 인한 부작용의 가능성도 있으며, 무엇보다도 기존의 표적체료제는 표적단백질에 붙어 활성을 저해해야 치료제로써 효과를 발휘할 수 있는데 이런 치료제는 효소가 아닌 단백질(non-enzymatic proteins)이나 스캐폴딩 단백질(scaffolding proteins)과 같은 단백질에는 전혀 소용이 없기 때문에, 질병을 일으키는 단백질 중 약 80% 정도를 차지하는 개발하기 어려운 타겟(undruggable target)에 대한 약물은 개발할 수 없다는 한계가 있었다.
이번 기사에서는 이러한 한계를 극복할 수 있을 것으로 기대되는 생물공학 기술을 소개하고자 한다. 바로 표적 단백질 분해(targeted protein degradation, 이하 TPD) 기술이다. TPD 기술의 개념은 간단하다. 기존의 방법처럼 질병에 관여하는 표적단백질을 저해하는 방식으로 질병을 치료하는 것이 아니라, 아예 그 표적단백질을 제거하자는 것이다. 이렇게 표적단백질을 제거하는 방법으로는 우리 몸의 두 가지 시스템을 이용할 수 있는데, 첫 번째는 유비퀴틴-프로테아좀 시스템(Ubiquitin-Proteasome System)이며, 두 번째는 자가포식-리소좀 시스템(Autophagy-Lysosome System)이다. 유비퀴틴-프로테아좀 시스템은 특정 단백질에 단백질을 제거하라는 표식인 유비퀴틴이라는 단백질을 붙이고 이 표식을 인식한 프로테아좀이 단백질을 제거하는 시스템이다. 한편, 자가포식-리소좀 시스템은 세포 내 물질이나 세포소기관을 막으로 둘러싸고 다양한 가수분해 효소를 포함하고 있는 리소좀과 결합하여 막 내의 물질을 분해하는 시스템이다. 이러한 두 가지 단백질 분해 방법을 활용하여 표적단백질을 제거하고자 하는 시도가 바로 TPD 기술인 것이다.
TPD기술에 대해 조금 더 자세히 살펴보자. 앞서 말했던 두 가지 단백질 분해 방법 중 유비퀴틴-프로테아좀 시스템을 이용하는 것이 PROTAC(Proteolysis-targeting chimera)이다. PROTAC은 표적단백질에 붙는 부분(리간드)과 E3 연결효소(E3 ligase, 기질에 유비퀴틴을 붙이는 효소)에 붙는 영역이 서로 링커를 통해 연결되어 있는 형태이다. 이를 통해 분해하고 싶은 표적단백질과 E3 연결효소를 물리적으로 가깝게 만들어 표적단백질에 유비퀴틴을 쉽게 붙일 수 있도록 하고 결국 유비퀴틴 태그가 붙은 표적단백질이 프로테아좀에 의해 분해되도록 유도하는 것이다.
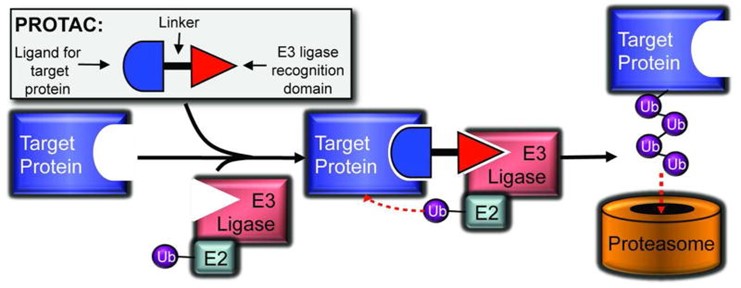
Figure 1 PROTAC의 작용 참고 그림
두 번째로 자가포식-리소좀 시스템을 이용하는 것은 AUTOTAC(Autophagy-targeting chimera)인데, PROTAC과 거의 비슷하다. 단지 다른 점이 하나 있다고 한다면 AUTOTAC은 E3 연결효소에 붙는 영역 대신 자가포식 수용체(autophagy receptor)에 붙는 영역을 가지고 있다는 것이다. 그러므로 AUTOTAC은 표적단백질에 대해 자가포식이 일어나게 해서 표적단백질이 분해되도록 한다. 그리고 자가포식-리소좀 시스템을 이용하면 단백질 응집체(protein aggregates)나 세포소기관까지 분해할 수 있기 때문에 AUTOTAC은 미토콘드리아 관련 질병이나 단백질의 응집에 의해 발생하는 질병을 해결할 수 있는 거의 유일한 방법으로 주목받고 있다.
TPD 기술은 앞서 설명한 대로 표적단백질을 저해하는 대신 제거하는 기술이기 때문에 기존 표적치료제가 갖고 있던 약효가 미미해지는 문제점을 해결할 수 있고, 효소가 아닌 단백질에도 작용할 수 있다. 또 표적단백질은 분해되지만 약물은 촉매처럼 작용하여 분해되지 않고 남아서 계속 표적단백질을 제거할 수 있으므로 상대적으로 적은 농도의 약물을 사용할 수 있다는 장점이 있다. 또 표적단백질에 붙는 부분(리간드)의 경우 기존의 표적치료제를 만들기 위해 연구되었으나 효율성의 문제 등 여러 이유로 개발이 중단되었던 많은 후보 리간드들을 활용할 수 있다는 점도 TPD 기술이 주목받는 이유이다.
지금까지 신약 개발에 새로운 바람을 불러일으키고 있는 기술인 표적 단백질 분해(TPD) 기술에 대해 살펴보았다. 아직 한참 연구개발 중인 분야이지만 이 기술을 통해 미래에는 좀 더 효과가 좋고 부작용이 적은 혁신 신약들이 개발될 것을 기대해본다.
[참고 문헌]
Corson TW, Aberle N, Crews CM. “Design and Applications of Bifunctional Small Molecules: Why Two Heads Are Better Than One”. ACS Chem Biol. 2008 Nov 21;3(11):677-692.
BIO TIMES. “표적 단백질 분해 기술(TPD), 난치성 신약 개발의 다크호스 되나”
http://www.biotimes.co.kr/news/articleView.html?idxno=7044
전자 신문. “[사이언스온고지신]신약 개발 게임체인저, 표적 단백질 분해 기술”
https://n.news.naver.com/article/030/0003029247?sid=101
추가적으로 서울대학교 생물공학 강의의 내용을 참고하였습니다.



