[2025년 9월 신임교수 인터뷰] 생명과학부 박상우 교수님을 소개합니다!
자연대 홍보기자단 자:몽 7기 | 송주형
*소속 : 생명과학부
*연구분야 : 감염병 모델링, 생태학, 생물정보학
*E-mail : sangwoopark@snu.ac.kr
*Tel : 02-880-4417
올해 9월에 서울대학교 생명과학부로 새로 부임하신 박상우 교수님을 인터뷰했다. 교수님께서는 수리 및 통계 모델을 이용하여 감염병의 확산과 병원체 집단 전체의 동역학을 이해하기 위한 연구를 하고 계신다. 데이터와 수학적 이론, 그리고 모델링을 통해 생물학적, 생태학적 질문에 대한 답을 찾고 있는 교수님의 이야기를 들어보자.

생명과학부 신임교수 박상우 교수님 (사진 = 박상우 교수님 제공)
1. 올해 새로 부임하신 만큼 아직 교수님에 대해 모르는 학생들이 많을 것 같습니다. 학생들을 위해 교수님에 대한 간단한 소개 부탁드립니다.
안녕하세요, 저는 이번 2025년 9월부터 서울대학교 생명과학부에 조교수로 부임하게 된 박상우라고 합니다. 저는 학부 때 캐나다에 있는 맥마스터 대학교라는 곳에서 수학과 통계학을 전공했었고, 박사학위를 프린스턴 대학교에서 생태학 및 진화생물학 전공으로 2024년에 졸업했습니다. 그 이후 시카고 대학교에서 박사후 연구원을 1년간 하다가 서울대학교로 오게 되었습니다. 현재 연구 분야는 간단히 얘기해서 감염병 모델링을 하고 있는데, 이 부분은 앞으로 인터뷰하면서 더 자세히 말씀드리겠습니다.
2. 서울대학교의 신임 교수님이 되신 소감이 궁금합니다.
제가 중학교 때부터 캐나다에 살았고, 또 박사 이후부터는 미국에서 살게 되서 한국에 돌아올 수 있을지 잘 몰랐는데 이렇게 돌아오게 되서 정말 기쁩니다. 그리고 한국에서 어떤 연구를 할 수 있을지 기대가 되고, 제가 하는 연구분야인 감염병 모델링이 한국에는 아직 낯선 분야라 조금 걱정도 있었는데 서울대에 와서 강의를 한번 해보니 학생들이 되게 관심 있어하는 것 같아서 안심도 되고 기대가 되는 것 같습니다.
3. 교수님의 연구 분야에 대한 간단한 소개 부탁드립니다.
먼저 확진자 수가 오르고 내리는 현상을 epidemic wave라고 부르는데 이 wave가 언제 어떻게 나타나는지에 대한 메커니즘을 추론하고 모델을 통해서 미래에 언제 wave가 발생할지 예측을 합니다. 사실 감염병 모델링이라는 분야가 생태학 모델링에서 파생되었는데요, 그래서 최근에는 감염병 데이터를 통해서 생태학적인 질문에 답을 할 수 있을까라는 고민을 하면서 다른 연구들도 진행하고 있습니다.
4. 교수님께서 현재 전공을 공부하시게 된 계기는 무엇인가요?
제가 학부생 1학년 때부터 연구실 생활을 했었습니다. 주변 친구들이 다 연구를 하길래 저도 연구를 하고 싶어서 지도교수님을 찾아갔는데 그때 교수님께서 여러 연구 주제들을 제시하셨습니다. 교수님께서는 수학 및 통계학과1 교수님이셨는데 수학과 통계학 자체뿐만 아니라 이를 이용해서 생태학과 진화, 그리고 감염병도 연구하시는 분이셨습니다. 그때 당시에는 제가 수학이나 통계학에 대해 많이 알고 있지는 않아서 여러 연구 주제들 중 그나마 제가 가지고 있던 지식으로 어느 정도 이해할 수 있는 주제였던 감염병 연구를 선택했습니다. 학부 때 연구실 생활을 하면서 현재 하고 있는 연구에 필요한 수학적, 통계학적인 테크닉들에 대한 기반을 많이 다졌고, 연구를 하다보니 재밌어서 이 분야로 대학원까지 가게 되었습니다.
1) 맥마스터 대학교는 수학, 통계학이 별개의 학과로 나뉘어져 있지 않고 하나의 학과로 합쳐져 있다. (McMaster University Department of Mathematics & Statistics)
5. 교수님께서는 기후와 감염병 확산 사이의 관계에 대해서도 연구하시는 것으로 알고 있습니다. 기후와 감염병 확산 사이에는 어떠한 관계가 있나요?
호흡기 바이러스 중에 겨울에 유행하는 바이러스도 있고, 봄이나 가을에 유행하는 바이러스들이 있는데요, 감염병의 유행 시기를 결정짓는 요소들 중에 바이러스의 감염성에 습도가 굉장히 중요한 영향을 미친다는 사실이 숨겨져 있습니다. 특히 계절성 인플루엔자(Seasonal Influenza)나 RSV(Respiratory Syncytial Virus, 호흡기세포융합바이러스) 같은 경우에 실험실 수준에서, 그리고 인구 집단 수준에서도 이 관계가 잘 성립한다는 것이 알려져 있습니다. 바이러스의 감염성은 비습2에 대한 함수로 나타낼 수 있습니다. 온대 지역에서는 기초감염재생산수3가 비습에 대해 지수함수적 관계를 가진다는 연구 결과도 있고, 열대 지역에서는 전파율(transmission rate)이 비습과 이차함수적 관계(quadratic relation)를 가진다는 연구도 있습니다. 이차함수적 관계를 가질 때에는 습도가 낮거나 높을 때 바이러스의 감염성이 높지만, 중간 단계의 습도에서는 바이러스의 감염성이 떨어집니다. 이로 인해 바이러스의 유행 시기가 주기성을 가지게 됩니다.
습도가 바이러스의 감염성에 영향을 주는 메커니즘은 여러 가지가 제시되어 있는데, 건조할수록 증발을 통한 바이러스 입자의 공기 중 부유 시간이 증가하기도 하고, 습도가 비강 통로에서의 바이러스 배출에 영향을 주기도 하고, 바이러스의 생존력 자체가 습도와 상관관계를 가지기도 합니다.
2) 비습(specific humidity): 공기 1kg에 들어있는 수증기의 질량이다. 즉, (수증기의 질량/(수증기의 질량 + 건조 공기의 질량))이다. 단위: g/kg
3) 기초감염재생산수(Basic Reproductive Number): 면역이 없는 집단에 감염병이 유입되었을 때 첫 감염자를 통해 추가적인 감염자가 몇 명이 생기는지를 나타내는 수
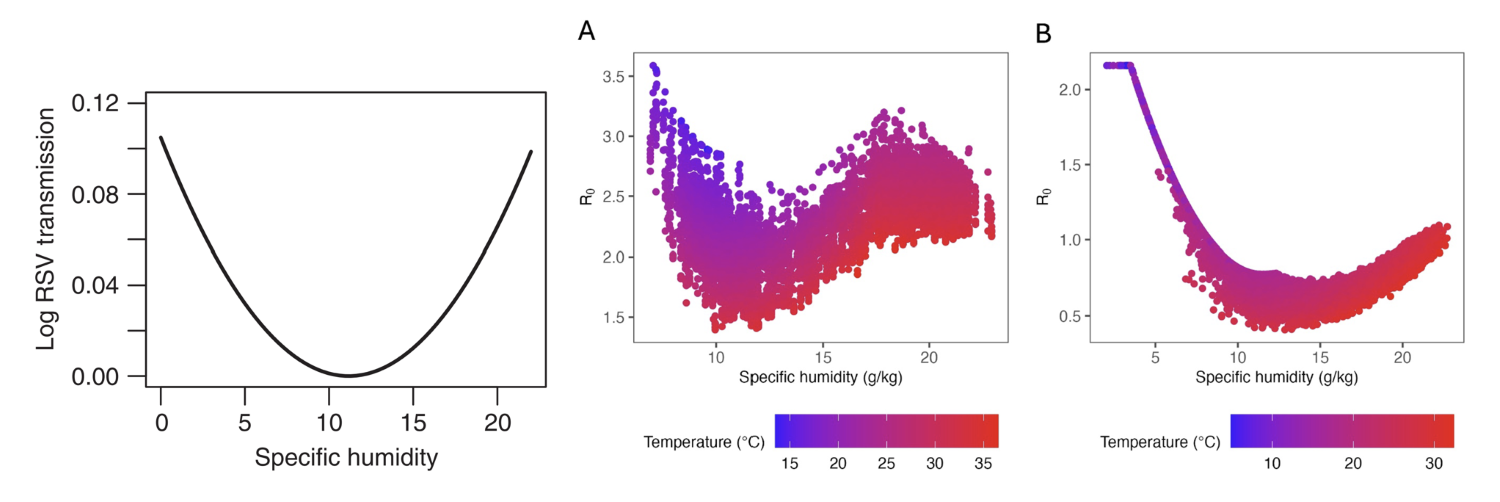
그림 1. (좌측)RSV의 감염성과 비습 사이의 관계를 보여주는 그래프. (출처 = Baker et al., 2019)
(우측)인플루엔자의 기초감염재생산수와 비습, 온도와의 관계를 보여주는 그래프. A는 방글라데시 다카에서, B는 홍콩에서 수집된 데이터를 통해 얻어진 그래프이다. (출처 = Stamper et al., 2025)
더 나아가 공간적으로 봤을 때, 지역에 따라 유행 시기에 차이가 발생하는 것도 기후와의 연관성을 이용해 설명할 수 있습니다. 미국과 멕시코에서 RSV의 유행 시작 시점이 온도, 비습, 강수량과 상관관계를 가진다는 연구결과가 보고된 바 있고, 이를 수학적 모델에도 집어넣어 미래에 기후가 변화했을 때 감염병의 확산이 어떻게 변화하는지 예측하기도 합니다.
또, 습도나 온도와 같은 기후 변수들이 사람들의 행동에도 영향을 줄 수 있는데요, 가령 습도가 높거나 기온이 높은 날에는 사람들이 실내에만 있게 되어 감염병이 더 많이 전파될 수도 있을 겁니다. 이렇게 사람들의 행동도 모수화(parameterization)하여 수학적 모델에 넣어 기후와 사람들의 행동이 감염병 확산에 어떻게 영향을 주는지 분석하고 감염병 확산의 예측을 향상시키려고 하고 있습니다.
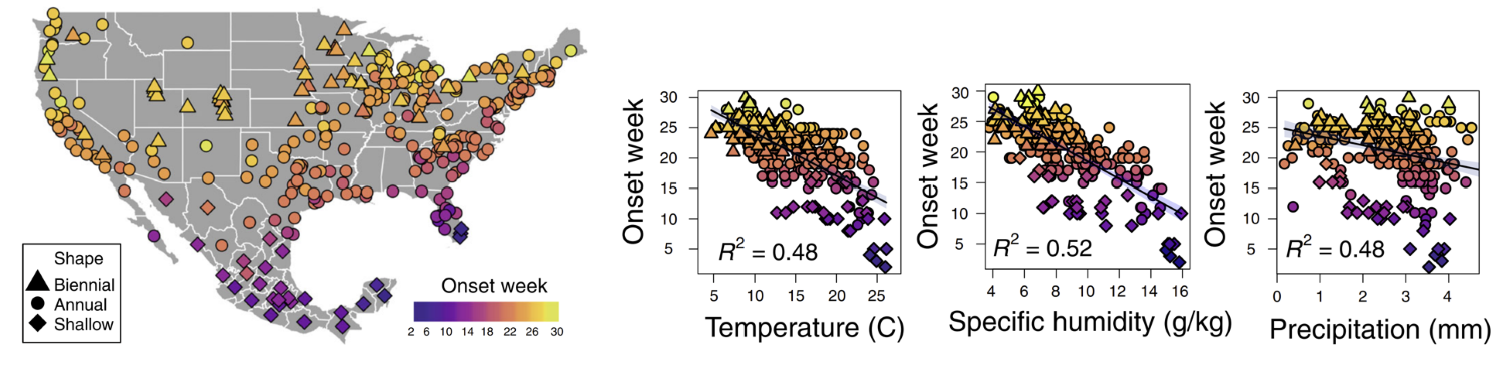
그림 2. (좌측)미국과 멕시코에서 RSV의 유행 시작 시기의 분포. 색깔이 노란색에 가까울수록 유행 시작 시기가 늦다는 것을 의미한다. 남쪽에서 북쪽으로 올라갈수록 유행 시작 시기가 점점 늦어지는 것을 볼 수 있다. 이러한 공간적 분포의 기저에는 기후의 영향이 깔려있다. (우측)RSV의 유행 시작 시기와 온도, 비습, 강수량과의 상관관계를 보여주는 그래프. (출처 = Baker et al., 2019)
5-1) 기후와 감염병 확산 사이의 관계에 대해 앞으로 어떤 연구들을 하실 계획인가요?
지금까지 감염병을 하나씩 따로 봤다면, 앞으로는 여러 감염병들을 동시에 보는 게 중요하다고 생각합니다. 그동안 제가 한 연구들도 그렇고 다른 사람들이 한 연구에서도 여러 가지 감염병들 사이의 상호작용이 중요한 것 같다는 결과들이 계속 보이고 있는데, 특히나 제가 관심 있는 것은 감기입니다. 감기 바이러스가 엄청 많은데, 바이러스마다 유행 시기가 다 달라요. 조금씩 한 달, 두 달 정도의 차이가 날 때도 있고, 아니면 아예 유행하는 계절이 서로 다른 바이러스들도 있습니다. 이러한 차이가 나타나는 이유가 과연 기후에 대한 반응이 각각 다 달라서 그런 건지, 아니면 뭔가 면역과 관련해서 다른 시기에 유행함으로써 더 잘 확산될 수 있는 이점이 있어서 그런 것인지에 대한 질문을 할 수 있습니다. 후자의 경우에 대해서 조금 더 자세히 설명하자면, 왜 유행하는 시기가 다르게 나타나는지에 대해 다음과 같은 가설을 세워볼 수 있습니다. 예를 들어 겨울에는 많은 바이러스가 유행하니까 다른 바이러스들이 유행하는 시기를 피해서 어떤 바이러스 A가 봄에 유행한다면 A의 입장에서는 겨울철에 다른 바이러스들로 인해 면역력이 떨어진 상태에서 감염시킬 수 있으니까 A가 더 잘 확산될 수 있을 겁니다. 이런 메커니즘을 통해 바이러스들의 유행 시기에 차이가 날 수 있다고 볼 수 있겠죠. 따라서 정말로 이런 면역력의 차이에 의해서 유행 시기가 달라지는 건지, 아니면 바이러스마다 기후에 대한 반응이 다 달라서 그런 건지 고민해보고 있고, 이를 연구해보고자 합니다.
6. 여러 감염병들 사이의 상호작용을 설명하는 수학적 이론(Pathogen Invasion Theory, PIT)을 만드신 것으로 알고 있습니다. Pathogen Invasion Theory란 어떤 이론이고, 구체적으로 어떤 연구를 하신 건가요?
이 연구는 생태학적인 고민에서부터 시작을 했는데요, 생태학에서 공존(coexistence)이라는 주제가 있습니다. 어떻게 이렇게 많은 종들이 같이 살아나갈 수 있는가라는 건데, 예를 들면 식물을 보면은 식물 종류가 되게 많고 식물마다 자라는 속도도 다 다른데 왜 가장 잘 자라는 식물이 다 우점하지 않고 어떻게 다양한 식물들이 같이 자랄 수 있는가와 같은 고민을 생태학자들이 오랫동안 해왔었어요. 그래서 Chesson이라는 교수님이 제시한 Modern Coexistence Theory(MCT, 현대 공존 이론)라는 수학적 이론이 있습니다. 공존을 설명하는 생태학적 이론이죠.
그런데 감염병에도 비슷한 고민이 있어요. 예를 들면은 코로나라던가 독감 같은 경우에는 새로운 변종이 나올 때마다 이전 변종이 사라집니다. 이 변종들은 공존할 수 없다는 것인데, 이를 ‘Strain replacement(균주 교체)’라고 합니다. 반면 다른 바이러스들은 그렇지 않습니다. 예를 들어 RSV 같은 경우에는 RSV A와 RSV B 두 가지 변종이 있는데, 같이 공존을 합니다. 뎅기열(Dengue)도 DENV1부터 DENV4까지 4가지 변종이 있는데 4가지가 서로 공존을 잘 합니다. 이렇게 변종들끼리 공존을 잘 하면 이를 ‘Stable coexistence(안정된 공존)’라고 부릅니다.
그러면 왜 어떤 감염병들은 변종들끼리 공존이 가능하고 어떤 감염병들은 가능하지 않은가라는 고민을 하게 되는 거죠. 그동안은 각 감염병을 개별적으로 봤을 때에 대한 연구는 많이 이루어져 왔었습니다. 하지만 서로 다른 감염병들끼리 비교한다고 했을 때 감염병마다 특성이 너무 다르기 때문에 감염병끼리의 비교는 지금까지 어려웠거든요. 그래서 감염병 개별적으로의 디테일을 보지 말고 감염병이라면 가져야 할 일반적인 성질들을 이용해보면 감염병끼리 비교할 방법이 있지 않을까해서 현대 공존 이론을 감염병 쪽으로 확장 및 적용해봤더니 감염병들끼리의 공존을 설명하는 이론적인 체계를 만들 수 있었습니다.
어떤 감염병 하나의 변이가 이미 인구 집단에 들어와서 평형(equilibrium) 상태를 이루고 있을 때, 새로운 변이가 이 인구 집단에 invade(침입)해서 번성할 수 있는가를 따져봄으로써 감염병 사이에 공존이 가능한지 불가능한지를 정량화할 수 있는 이론을 만들어낸 게 Pathogen Invasion Theory(PIT, 병원체 침입 이론)입니다. 감염병들 사이에 공존이 왜 가능하거나 불가능한지에 대한 메커니즘을 찾기 위한 이론인거죠.
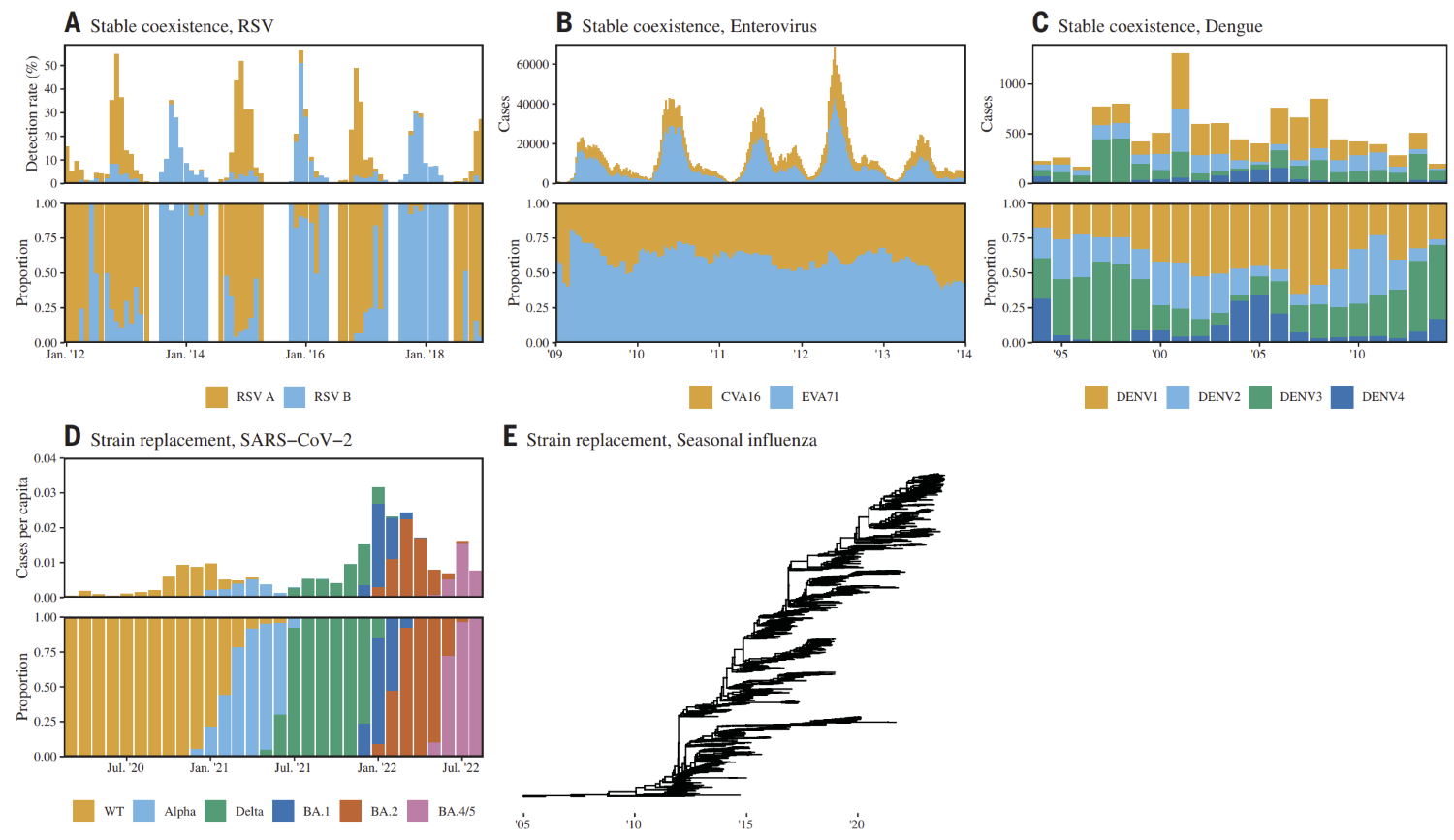
그림 3. 감염병마다 공존 패턴이 어떻게 되는지를 보여주는 그래프. A(RSV), B(장내바이러스), C(뎅기열)은 변종들끼리 공존하지만, D(코로나바이러스), E(인플루엔자)는 새로운 변종이 나타날 때마다 이전 변종들이 멸종하는 모습을 보여준다. (출처 = Park et al., 2024)
그동안 감염병의 공존에 대해서는 생태학적 이론을 직접적으로 가지고 와서 해석하는 연구들이 이전에 많이 있었습니다. 감염병 유행 패턴을 보면서 현대 공존 이론에서 나오는 해석을 감염 패턴에 적용해서 공존의 메커니즘을 정성적으로 추정하는 연구는 많이 이루어졌었는데, 이를 정량화하는 방법은 거의 전무했었습니다.
그래서 정량화를 했고, 또 지금까지는 주로 특정 감염병 모델을 통해서 연구했다면, PIT는 사실 모델이 아니고 이론이라서 어떠한 감염병 모델을 줘도 PIT에 넣을 수 있습니다. 그러니까 새로운 이론을 통해서 서로 다른 감염병 모델끼리 비교가 가능해지는, 일종의 가교 역할을 하는 이론인거죠.
PIT에서 중요한 개념은 Mutual Invasion(상호 침입)이라는 개념입니다. 하나의 감염병이 인구 집단에서 평형 상태로 존재하고 있을 때 다른 경쟁하는 변종이 그 인구 집단에 침입할 수 있는지를 Invasibility(침입 가능성)라고 하는데, 서로서로 침입할 수 있으면 상호 침입이 가능하다고 얘기합니다. 그러니까 a라는 변종이 평형 상태에 있을 때 b라는 변종이 침입할 수 있고, b가 반대로 평형 상태에 있을 때 a가 b에 침입할 수 있으면, 상호 침입이 가능한 것입니다. PIT를 통해 두 감염병 간의 상호 침입이 가능한지를 정량적으로 구할 수 있습니다.
먼저 두 종 사이의 상호 침입성을 알아보기 위해서는 두 가지 개념을 알아야하는데요, 첫 번째는 Niche overlap(생태적 지위 겹침)이라는 변수입니다. 두 종이 얼마나 비슷한 환경자원을 사용하는가를 나타내는 척도입니다. 두 종이 비슷한 환경자원을 사용할수록 생태적 지위가 그만큼 겹친다고 볼 수 있습니다. 생태적 지위 겹침은 0과 1 사이의 값을 가지도록 정의되는데, 0에 가까울수록 생태적 지위가 분리되어 있어 서로 종간 겹침이 거의 없고, 공존하기가 쉬움을 의미합니다. 반면 1에 가까운 값을 가지면 거의 비슷한 생태적 지위를 가지고 있어 서로 비슷한 환경자원을 사용하므로 종간경쟁이 심함을 의미합니다.
여기서 생태적 지위 겹침을 1에서 뺀 값을 새로운 변수로 설정할 수 있습니다. 이 변수 역시 0과 1 사이의 값을 가지게 되고, 이 변수가 가지는 값에 대응되는 의미는 생태적 지위 겹침과 정확히 반대입니다. 이 변수는 값이 0에 가까울수록 지위가 비슷해서 종간경쟁이 심하다는 것을 의미하고, 1에 가까울수록 지위가 달라 종간 겹침이 없고 공존하기가 쉽다는 것을 의미합니다. 따라서 1에서 생태적 지위 겹침을 빼준 값을 ‘Niche difference(생태적 지위 차이)’라고 부르게 됩니다. PIT에서는 감염병들 사이의 지위 차이를 보기 때문에 특별히 ‘Immunological niche difference(면역학적 지위 차이)’라는 단어를 사용합니다. 면역학적 지위 차이는 아래의 식과 같이 구할 수 있습니다.
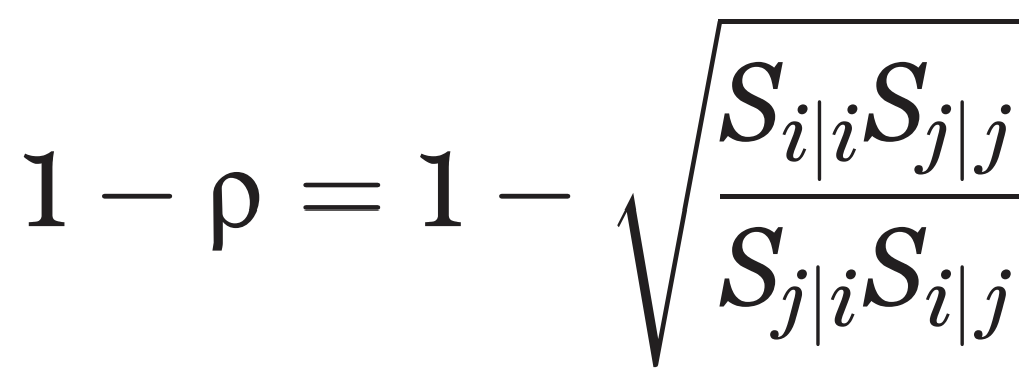
ㅤ
ρ는 생태적 지위 겹침(niche overlap)이고, Sⱼ|ᵢ는 감염병 i가 인구 집단 내에서 평형 상태에 있을 때 실질적으로 감염병 j에 취약한(=감염될 수 있는) 개체수의 비율을 의미합니다. 이 비율은 데이터를 통해 정량적으로 구할 수 있습니다.
두 번째는 Fitness difference(적합도 차이)라는 변수입니다. 이 변수는 두 종이 각각 상대방이 평형 상태일 때의 전염성을 비율로 나타낸 값입니다. 적합도 차이는 아래의 식으로 구할 수 있습니다.
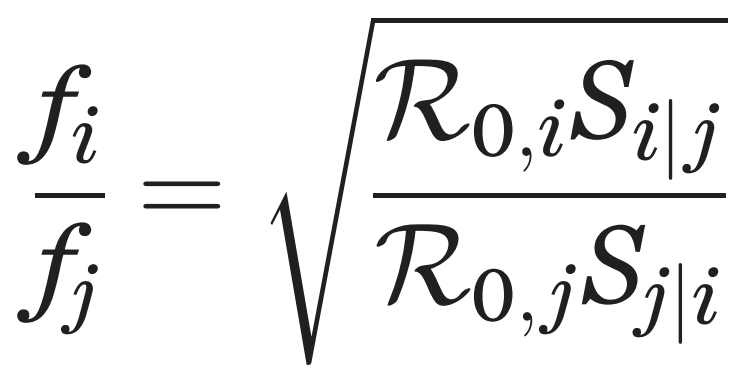
ㅤ
R₀,ᵢ 는 감염병 i의 기초감염재생산수를 의미합니다.
이제 두 종 사이의 상호 침입이 가능하다는 조건은 아래의 부등식으로 표현될 수 있습니다.
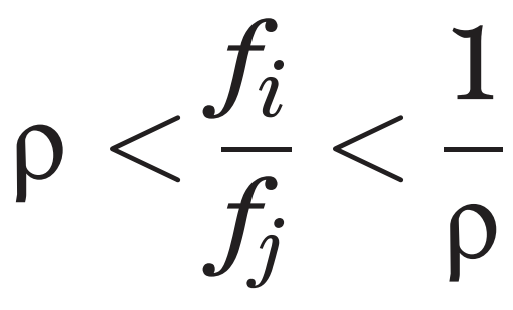
ㅤ
감염병 모델과 데이터를 이용하여 두 감염병 사이의 면역학적 지위 차이와 적합도 차이를 정량적으로 계산할 수 있고, 이를 그래프로 표현하면 다음과 같습니다.
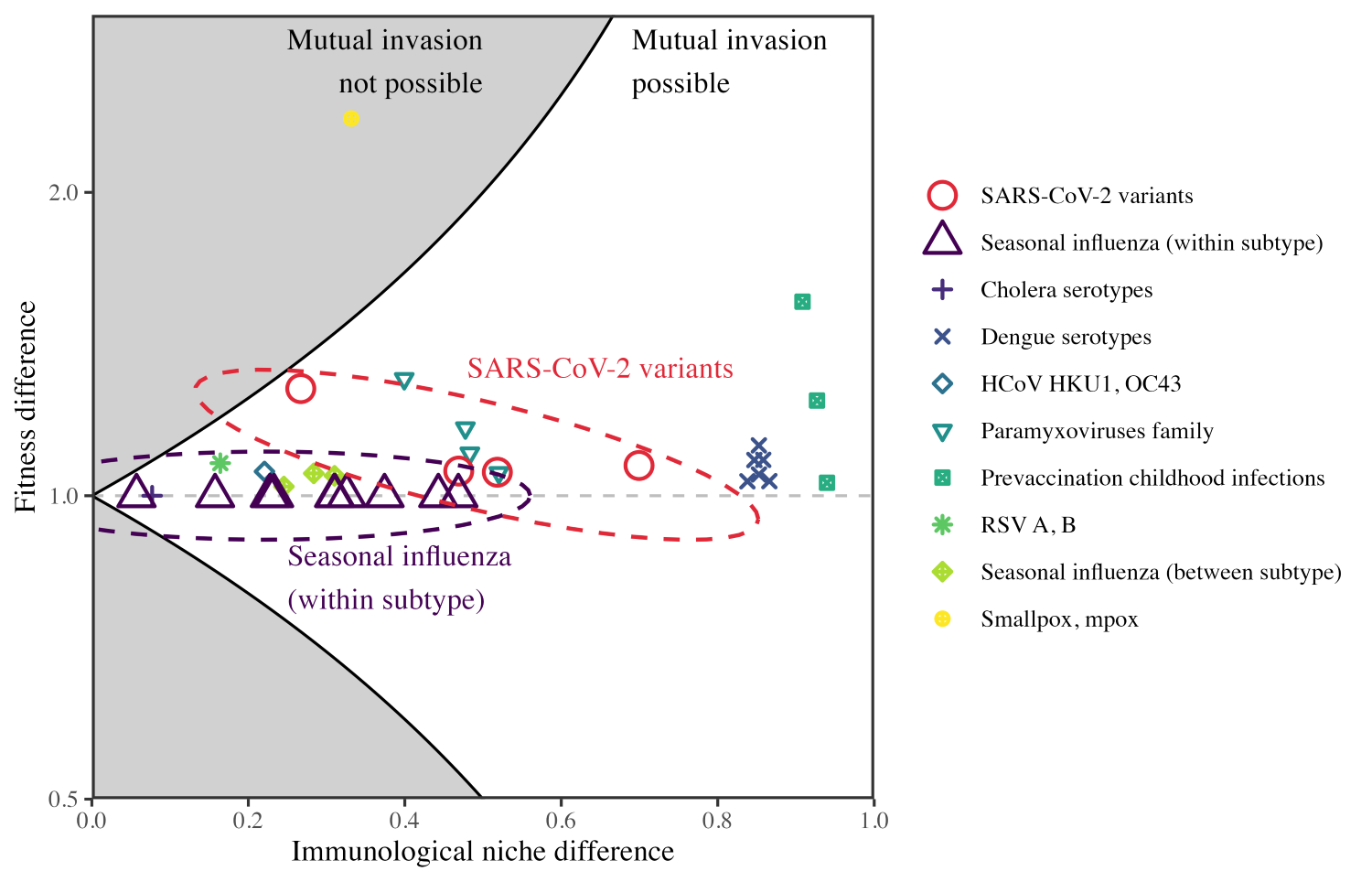
그림 4. 자세한 설명은 기사 본문 참조. (출처 = Park et al., 2024)
그림 4에서 가로축은 면역학적 지위 차이, 세로축은 적합도 차이입니다. 앞서 구한 부등식이 그림 4에서 회색 영역과 하얀색 영역을 나누는 검은색 실선으로 표현됨을 볼 수 있습니다. 하얀색 영역은 상호 침입이 가능한 영역, 회색은 그렇지 않은 영역입니다. 각 점들은 백신 접종이 이루어지지 않았을 때 두 감염병 사이의 면역학적 지위 차이와 적합도 차이를 계산한 결과입니다. 빨간색 o로 표시된 점들은 코로나바이러스의 변종들끼리 비교한 결과, 세모로 표시된 점들은 계절 인플루엔자의 변종들끼리 비교한 결과, +자로 표시된 점들은 콜레라의 변종들, x자로 표시된 점들은 뎅기열의 변종들끼리 비교한 결과입니다. 대부분 상호 침입이 가능한 영역에 들어가있음을 알 수 있습니다.
거의 유일하게 노란색 점 하나가 상호 침입이 불가능한 영역에 들어가있음을 알 수 있는데, 천연두(Smallpox, 두창)와 원숭이두창바이러스(Monkeypox virus, MPXV)를 비교한 결과입니다. 즉, 천연두가 인구 집단 내에서 평형에 있을 때 원숭이두창바이러스가 인구 집단에 침입하지 못한다는 의미입니다.
근데 여기서 상호 침입이 가능한지를 보고 싶은 이유는 원래 고전적인 생태학적 관점에서 봤을 때, 특히 현대 공존 이론에서는 상호 침입이 가능하다면 공존이 가능하다는 결론이 나오기 때문입니다. 그러나 Strain replacement(균주 교체)를 보이는 인플루엔자랑 코로나는 PIT에 따르면 상호 침입이 가능한 영역에 속합니다. 기존의 현대 공존 이론에 따르면 인플루엔자와 코로나는 안정된 공존의 모습을 보여야 하는데, 왜 상호 침입은 가능하면서 공존은 불가능한지를 봤더니, 상호 침입성이 문제가 아니고 상호 침입 이후에 일어나는 일이 중요하다는 것을 알게 되었습니다.
사실 그래서 이 논문에서 보인 것은 균주 교체를 보이는 바이러스조차도 상호 침입은 가능하다는 것과, 상호 침입성 자체가 공존에 대한 limiting factor(한계 요인)이 아니고 침입 이후에 일어나는 일들이 한계 요인이라는 것이죠.
다만 이 이론도 한계점은 분명히 존재합니다. 현대 공존 이론도 그렇고 PIT의 가장 큰 한계점은 Pairwise Comparison(쌍별 비교)밖에 가능하지 않다는 것입니다. 즉, 한 번 비교할 때 두 가지까지만 비교가 가능합니다. 두 가지 종이 공존할 수 있을지 비교하는 건 가능하지만, 세 가지 종이 공존할 수 있을지를 한번에 판별하는 것이 불가능하다는 거죠. 사실 세 가지 혹은 네 가지 이상의 종들이 서로 공존할 수 있는가는 예측하기가 원래 어렵습니다.
비교를 할 때에는 예를 들어 RSV A, RSV B처럼 특정 감염병의 변종들끼리 비교할 수도 있고, 아예 다른 종류의 감염병끼리도 비교를 할 수가 있어요. 다만 완전 상관이 없는 감염병을 두면 비교를 해도 아무 의미가 없을 수도 있죠. 근데 또 한편으로는 상관이 없어 보이는 것 같은 감염병들도 최근에는 실제로 면역학적으로 상호작용이 일어나고 있는 것 같다는 증거들이 나오고 있기 때문에 비교하는 대상을 잘 선택하는 게 중요하다고 생각합니다.
7. 교수님께서 연구하시는 분야는 생태학에 속한다고 봐야 할까요?
저는 감염병을 연구하기 때문에 제가 하는 연구는 보건이나 역학4적인 함의(epidemiological implications)를 가질 수밖에 없습니다. 그러나 제가 던지는 질문들의 바탕에는 생태학적인 관점이 깔려 있습니다. 예를 들어, ‘왜 공존을 하는가?’, ‘왜 감염병의 유행이 주기성을 가지는가?’, ‘왜 그 주기가 2년 혹은 3년인가?’ 등의 질문들이죠. 이처럼 저는 생태학적 질문을 출발점으로 전염병을 바라보고 연구합니다. 미국에서는 이러한 분야를 ‘Disease Ecology(질병 생태학)’이라고 부르며, 이를 전담하는 ‘Ecology and Evolution of Infectious Diseases’ 학회도 별도로 존재합니다.
특히 저는 수학을 이용해서 질병 생태학을 연구하고 있는데, 새로운 생태학 이론을 세운다면 어떤 실험을 설계해야 하고 무엇을 검증해야 하는지에 대한 지표가 될 수 있습니다. 반대로 실험 결과가 이론과 다르다면 그 결과를 바탕으로 이론을 수정하고 발전시킬 수도 있습니다. 이렇게 실험과 이론이 서로 상호작용하며 발달하는 과정에서 수학적 모델이 핵심적인 역할을 한다고 생각하기 때문에 수학적 접근을 통한 연구가 매우 중요하다고 생각합니다.
4) 역학(Epidemiology): 특정 인구 집단 내에서 질병의 발생, 분포 및 경향과 양상을 분석하고 그 원인을 연구하는 학문이다. 역병을 연구하는 학문이라는 의미에서 초기에는 감염병을 예방하고 관리할 목적으로 발전되어 왔지만, 오늘날에는 환경오염, 스트레스, 생활습관 등으로 인한 비감염성 질환, 기타 각종 현상에 대한 원인 규명 등 다양한 영역으로 확장되었다.
8. 교수님께서 혈청 데이터(Serological Data)를 병원체 감시 데이터(Pathogen Surveillance Data)와 결합시켜 모델링 예측을 향상시키는 연구를 하셨는데, 구체적으로 두 데이터를 통합시키는 게 모델링 예측 향상에 어떻게 도움이 되는지 궁금합니다.
수학적으로 감염병 모델링을 하면 감염병이 어떻게 퍼지는지도 예측을 할 수 있지만, 그 퍼짐에 따라서 사람의 면역력이 어떻게 변화하는지도 같이 예측할 수 있습니다. 다만 사람 개개인의 면역력이라기보다는 인구 집단 전체의 면역이죠(Population Immunity). 감염병이 많이 퍼졌을 때에는 사람들 사이에 항체가 생기면서 면역이 있는 사람이 많아졌다가 시간이 지나면 새로운 유아들이 출생하기도 하고 면역을 안 가진 사람들이 늘어납니다. 그러다보면 다시 감염병이 많이 퍼지게 되고, 면역을 가진 사람이 많아지고⋯ 이런 것들을 추적할 수 있는데 보통은 이를 추적할 때 병원체 감시 데이터, 즉, 확진자 수의 변화에 집중을 했습니다. 확진자 수가 어떻게 변화하는지를 보면서 예측을 하는데, 확진자 수만 보면 한계가 많습니다. 왜냐하면 확진자라는 것은 어느 정도 증상이 심각해진 후 병원까지 와서 검사를 받아야 확진자 판정이 나기 때문에 확진자 수가 실제로 인구 집단에 얼마나 감염자가 많은가에 대한 대답을 하지 않습니다. 예를 들어 우리가 감기에 걸렸을 때 바로 병원에 가지는 않잖아요. 조금 심해도 약 먹고 학교에 가기도 하고. 그러니까 확진자가 100명이라 해도 실제로 감염된 사람은 10,000명, 100,000명 있을 수도 있습니다.
그래서 병원체 감시 데이터(확진자 수)만 가지고 예측이나 분석을 하기에는 한계가 있는데 혈청 데이터를 같이 분석하면 훨씬 더 정확하게 예측할 수 있습니다. 사람에게서 피를 뽑아서 검사했을 때 항체가 있는 사람은 이전에 감염이 된 적이 있다는 뜻이고, 항체가 없는 사람이 감염된 적이 없다는 뜻이니까 사람들을 대상으로 항체 검사를 하면 실제 감염률이 얼마나 되는지 더 잘 알 수 있습니다. 실제로 혈청 데이터를 수집해서 기존의 확진자 수 데이터랑 같이 통합시켜 예측을 해보니, 확진자 수 데이터만을 가지고 했을 때보다 더 정확하게 예측한다는 것을 보일 수 있었습니다.
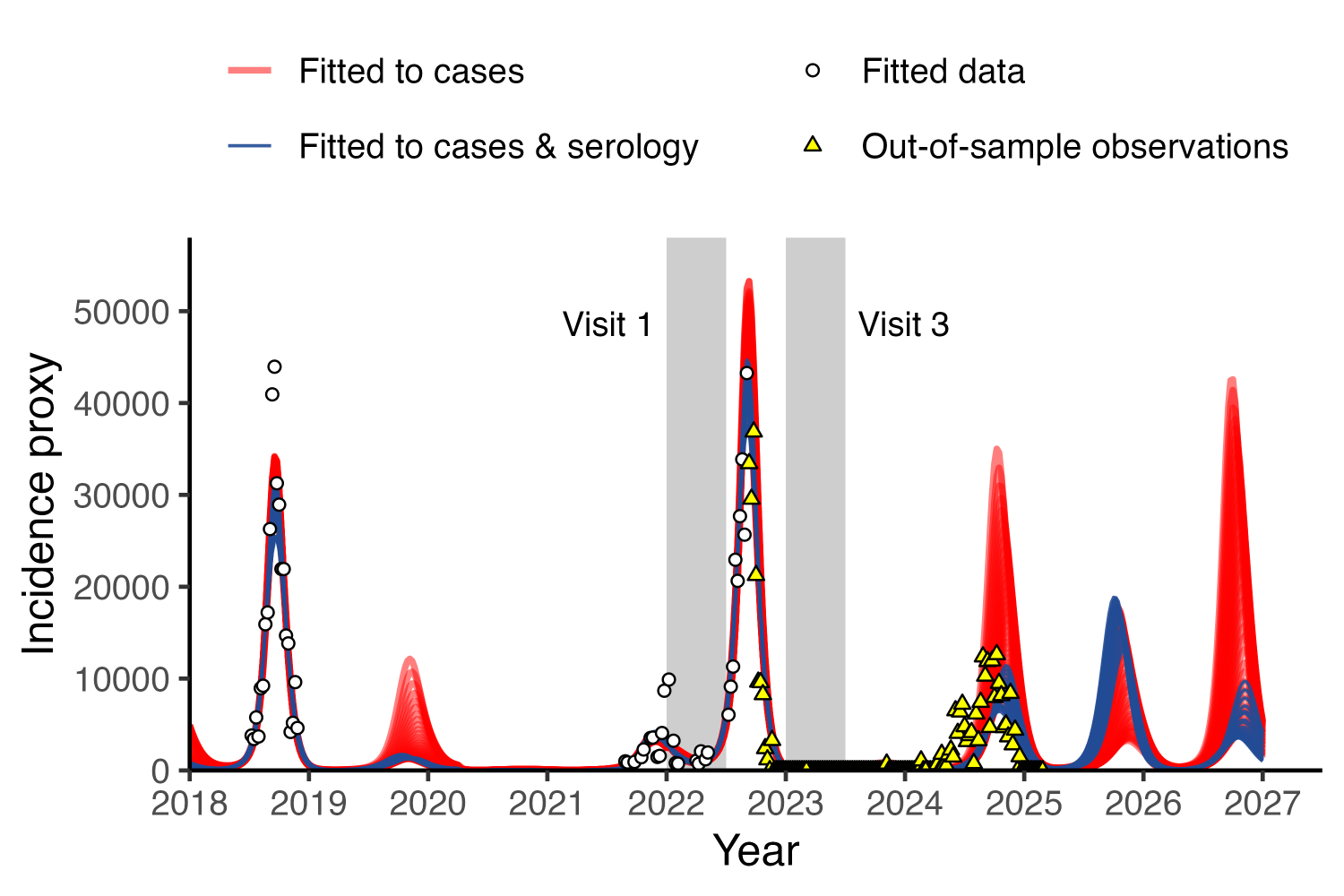
그림 5. 자세한 설명은 기사 본문 참조. (출처 = Park et al., 2025)
위 그래프는 Enterovirus D68 감염병의 확진자 수가 시간에 따라 어떻게 변하는지를 보여주는 그래프입니다. 빨간색 실선은 확진자 수 데이터만을 이용해 모델이 예측한 결과이고, 파란색 실선은 확진자 수와 혈청 데이터를 통합시켜 예측한 결과입니다. 노란색 삼각형 점은 예측 이후의 실제 확진자 데이터를 의미합니다. 특히 2024년을 주목해서 보면, 확진자 수 데이터만으로 예측했을 때 모델은(빨간색 실선) 2024년에 대규모 유행이 발생할 것이라는 점은 포착했지만, 유행 규모의 크기가 클지 작을지는 정확히 예측하지 못하는 것을 볼 수 있습니다. 반면, 혈청 데이터를 함께 통합한 모델(파란색 실선)은 예측 이후의 실제 확진자 데이터(노란색 삼각형 점)와 매우 잘 일치하는 결과를 보였습니다. 즉, 혈청 정보를 추가함으로써 모델의 예측 정확도가 크게 향상되었음을 보인 거죠.
8-1) 이 연구는 어떻게 시작하게 되셨나요?
이 바이러스가 실제로 발견된 것은 1962년 즈음에 처음 발견되었어요. 이게 호흡기 질환 바이러스인데, 보통은 감염되었을 때 증상이 감기 정도로 넘어가기 때문에 사람들이 신경쓰지 않았습니다. 그러다가 2014년에 갑자기 소아마비와 비슷한 증상을 가진 환자들이 늘어났는데 Enterovirus D68이 주요 원인인 것 같다는 연구들이 계속 나오기 시작하면서 2014년부터 관심을 받기 시작했습니다. BioFire라는 회사에서 이 바이러스를 검사를 하는 방법을 개발해서 이 바이러스에 대한 데이터가 있었기 때문에 그 회사랑 협업하여 Enterovirus D68의 확산에 대한 동역학(dynamics)를 연구했었고, 그러면서 이 감염병의 유행 주기도 예측하게 되었습니다.
이 감염병의 유행 주기는 2년입니다. 2014년, 2016년, 2018년에 유행했기 때문에 그걸 토대로 2020년 가을에도 유행할 것이라는 예측을 했었는데 그 예측을 했을 때가 2020년 초반이었습니다. 그런데 코로나로 인해 사회적 거리 두기를 시행하면서 2020년에 유행하지 않을 것이라고 다시 예측을 수정했고 실제로 2020년에 유행하지 않았어요(Park et al., 2021). 그다음 유행은 2022년이었습니다. 추후에 그러면 어떤 패턴으로 또 유행할지 모델링을 해서 예측 및 분석하는 논문을 제가 썼었는데(Park et al., 2023) 그때 확진자 수 데이터만 가지고 예측을 해보니까 불확실성이 컸었습니다. 그래서 혈청 데이터를 같이 합쳐서 예측을 한거죠.
사실 이 연구는 오래 걸렸어요. 이 연구가 혈청 데이터 수집은 2022년부터 시작했다고는 하지만, 논문은 2025년 8월에 나왔으니까 최소 3년은 더 걸린거죠. 실제 연구 계획은 훨씬 이전부터 했습니다. 2021년에도 연구해보자는 얘기를 했었던 것 같은데, 그때부터 계속 이런 연구를 하겠다는 얘기를 해서 연구하게 된 것 같아요.
그리고 계획 단계에서부터 모델링이 들어갔습니다. 왜냐하면 샘플 수를 얼마나 잡아야할지를 결정해야 하는데, 샘플이 많으면은 물론 좋지만 그만큼 돈과 노동력이 많이 들어갑니다. 혈청 데이터는 특히 어른도 아니고 0살부터 10살까지의 유아들에게서 얻어야 했기 때문에 부모님 동의도 받아야하고, 수집 과정이 까다로워서 어느 정도의 데이터가 있어야 유의미한 결과를 낼 수 있을지를 미리 책정해야 해서 모델링을 했습니다. 그러고나서는 같이 연구하는 다른 연구자들마다 어떤 분석 결과를 보고 싶은지, 추가적으로 어떤 데이터가 얼마나 있으면 좋을지, 혹은 이런 방향으로 모델링이 가능할지 아이디어를 주고 저도 모델링을 해보고 계속해서 서로 피드백을 하는 과정이 들어갑니다.
9. 연구를 진행할 때 다른 사람들과의 공동연구를 어떻게 진행하는지 그 과정이 궁금합니다.
감염병 연구에서는 공동연구를 하는 게 매우 중요한데, 저 같은 경우 의사분들이랑 협업을 많이 합니다. 의사분들을 위해 모델링을 해서 감염병 예측 결과를 주기도 하고, 의사분들께서 저한테 질문이나 데이터를 가지고 오는 경우도 있습니다. 또, 반대로 제가 뭔가 모델링하고 싶은 게 있는데 이를 위한 데이터 수집을 제가 요청할 수도 있고요.
다른 감염병 모델링 연구자들하고는 같이 새로운 이론을 개발하기도 합니다. 이론적인 연구를 할 때에는 주로 discussion(논의)를 기반으로 진행합니다. 왜냐하면 실험을 하는 게 아니다보니까 뭔가 나눠서 하기에는 어려울 수 있어요. 가끔 나누는 경우도 있긴 하지만 보통 누군가 먼저 하기는 해야 해요. 어떤 사람이 아이디어를 내서 이론을 어느 정도 세운 후에 다른 사람한테 아이디어를 묻는 거죠. 이 이론의 부족한 점이라던지, 놓친 점이 무엇이 있을지 등⋯. 결국에는 다른 사람의 관점에서 보는 게 중요하기 때문에 아이디어를 공유해서 서로 discussion을 하는 것이 제일 큰 것 같습니다. 최근 들어서는 코로나로 인해 온라인 화상채팅이 발달이 많이 되서 이제는 줌(zoom)으로 많이 합니다. 논문도 줌을 하면서 같이 작성하고 첨삭도 합니다.
누군가가 진행을 하면 그걸 토대로 여기서 앞으로 방향이 어떻게 나아갈 것인지, 뭐가 부족한 것 같은지 등을 의논하고, 누가 데이터를 가져오고 누가 모델링을 할 것인가 등의 역할 분담도 나눠서 연구를 진행합니다.
10. 앞서 말씀주신 연구들 외에 앞으로 하고 싶으신 연구가 있으신가요?
저는 생태학적인 연구에 조금 더 관심이 있습니다. 앞서 말했듯 감염병 모델들이 다 생태학 모델에서 기반이 되는데, 다만 모델이 조금 다릅니다. 감염병 시스템과 생태학적인 시스템은 근본적으로 다르기 때문에 그 차이를 모델을 통해 비교하고, 두 시스템을 이어줄 수 있는 이론을 개발하는 연구도 하고 있습니다. 또, 서울대에 실험하는 분들이 많이 계시니까 그분들과 같이 협업해서 연구도 진행해보고 싶습니다.
11. 연구를 진행하다가 뜻대로 풀리지 않는 상황이 생기거나 어려움이 생길 경우, 어떻게 극복하시나요?
연구라는 게 계속 잡고 있다고 풀리는 것이 아니기 때문에 저는 그냥 내려놓고 다른 걸 합니다. 산책할 수도 있고, 나가서 맛있는 걸 사 먹을 수도 있고, 노래를 들을 수도 있고, 아니면 다른 연구를 하기도 합니다. 아무래도 이론적인 연구를 하는 게 많다보니까 상대적으로 다른 걸 하기에 쉬운 것 같습니다. 실험 같은 경우에는 실험을 도중에 중단하는 게 힘들지만 이론적인 건 아무래도 뭔가 잘 안 풀리면 다른 문제를 잠깐 보다가 나중에 돌아오기가 쉬운 것 같습니다. 다시 돌아왔을 때에는 그동안 쌓인 경험치라던가 새롭게 배운 관점들이 푸는 데 도움을 주는 것 같습니다.
근데 연구가 안 될 때에는 많이 얘기해보는 것도 중요한 것 같아요. 다른 연구자분들, 지도 교수님이나 다른 멘토분들에게서 여러 관점을 얻다 보면 방향이 보일 때도 있더라고요.
11-1) 교수님께서는 구체적으로 어떤 상황에서 연구를 하다가 어려움을 느끼시나요?
어떤 분석을 했을 때 이런 결과가 나와서 이렇게 진행이 될 것 같다고 생각을 했는데, 막상 해보니까 분석 결과가 잘 안 나오지 않거나 분석이 실제로 더 어려울 때인 것 같습니다. 즉, 생각했던 방향으로 연구가 진행이 안 될 때 어려움을 느끼는 것 같습니다. 그게 생각과 다르게 오히려 좋은 결과가 나올 때도 있지만, 안 좋은 결과로 나와가지고 뭔가 지지부진한 경우도 있더라고요.
그런 경우에 저는 잠깐 쉬다가 나중에 돌아왔을 때에 해결되는 경우가 많았어요. 앞서 질문주신 PIT 논문 같은 경우에도 이런 연구를 하자는 얘기는 제가 박사 1년차 때부터 했습니다. 1년차 때부터 이런 걸 해보면 재밌지 않을까라는 논의를 계속 했었어요. 뭔가를 본격적으로 해본 건 아니었고, 그냥 논의만 계속 1년에 한두 번씩 ‘해보면 어떨까’ 했었죠. 답이 계속 안 나왔었는데 마지막 학년 시작하기 전 여름방학에 교수님이 논문 하나 보내줘서 읽어봤는데 그때도 그 논문 기반으로 뭔가 했을 때 잘 안 되서 다른 논문을 잠시 또 읽어보니까 아이디어가 생기더라고요. 그래서 교수님이랑 논의를 하고 아이디어를 시도해봤더니 갑자기 풀렸습니다.
연구가 안 될 때에는 계속 얘기 많이 하고, 쉬기도 하고, 다른 것도 하다가 언젠가 돌아오면은 될 수도 있고, 또 안 될 수도 있죠. 그러면 또 다른 거 하고⋯ 그렇게 연구하는 것 같습니다(웃음).
12. 교수님의 학부생/대학원생 시절 이야기가 궁금한데, 교수님께서는 학부생 때 어떤 동아리들을 하셨었나요?
저는 학부생 1학년 때 뮤지컬 공연을 했었어요. 뮤지컬에서 제가 노래를 부르지는 않았고, 편곡이랑 기타 연주를 했습니다.
12-1) 취미 활동으로는 어떤 걸 하시나요?
대학원생 때 전자음악 쪽으로 취미가 바뀌어서 지금은 전자음악 쪽으로 하고 있고, 기타는 옛날만큼은 연주하지 않습니다. 요즘은 편곡보다는 작곡을 주로 합니다. 이것도 대학원생 때부터 시작해서 신디사이저로 작곡하고 있습니다.
12-2) 체력관리는 어떻게 하시나요?
대학원생 때부터 클라이밍을 하고 있습니다. 바빠지면 못할 때도 있지만, 시간이 있을 때마다 클라이밍을 한 번씩 가려고 노력합니다. 또 걷는 걸 좋아해서 산책도 많이 해요. 클라이밍을 처음 시작하게 된 계기는 대학원생 때 아는 형이 같이 가자고 해서 시작하게 되었는데, 미국 대학원에서 클라이밍이 엄청 유행이에요. 특히 생태학을 하는 친구들 사이에서는 클라이밍을 한 번도 안 해본 친구는 없을 정도로 유행입니다.
13. 교수님을 계속 과학자이게 하는 원동력은 무엇인가요?
저는 연구하는 게 정말 재미있습니다. 새로운 걸 발견하는 것도 재미있고, 새로운 걸 배워가는 것도 재미있고, 학생들을 가르치는 것도 재미있습니다. 재미있다는 게 가장 큰 것 같습니다.
14. 교수님의 MBTI는 무엇인가요?
저는 INTP입니다. 다만 전에는 INTP의 비율이 다 높았는데 점점 비율이 비슷해지는 것 같아요. 원래는 엄청 P였는데 대학원 다니면서 J 같은 부분이 생기기도 하고 T였지만 점점 감정에 공감하게 되고 그러는 것 같습니다. 옛날에는 엄청 I라서 발표하는 것도 싫어했어요. 지금도 발표하면 긴장하지만 확실히 전보다는 말을 잘하게 된 것 같습니다(웃음).
15. 진로를 고민하는 학생들, 특히 교수님과 같은 분야를 연구하기를 희망하는 학생들을 위해 조언 부탁드립니다.
수학과 생물학을 동시에 공부하는 게 쉬운 일은 아닙니다. 양이 워낙 방대하거든요. 또, 학생마다 좋아하는 수학도 다르고 풀고 싶어하는 생물학적 문제도 다를 거에요. 그래서 일반적인 조언을 주기는 힘들지만 제가 줄 수 있는 가장 실질적인 조언은 그런 고민이 있다면 저한테 편하게 연락을 주면, 제가 같이 고민해줄 수 있고, 어떤 방향으로 공부를 할지에 대한 방향성을 제시해줄 수 있지 않을까하는 생각이 듭니다. 제가 꼭 우리 연구실에 들어오지 않아도 학생들하고 얘기하는 게 재밌기 때문에 편하게 연락주면 같이 고민해줄 수 있을 것 같아요.
생물학이 범위가 넓기 때문에, 학생마다 관심사가 굉장히 다를 수 있습니다. 예를 들어 어떤 학생이 암을 공부하고 싶은데 제가 생태학 책을 주면서 공부하라고 할 수는 없잖아요. 수학도 예를 들어 미분방정식을 공부하고 싶은데 기하학 책을 공부하라고 할 수 없으니까요. 연구 주제 같은 경우에도 뭔가 생물학적인 질문을 생각하고 싶은 친구도 있을 수 있고, 아니면 개발자의 마인드를 가지고 새로운 툴을 만들고 싶어하는 친구도 있을 수 있어요. 그 친구들마다 필요한 공부나 역량이 다르기 때문에 편하게 연락해주시면, 제가 도와줄 수 있는 한에서 도와줄 수 있을 것 같습니다.
16. 마지막으로 서울대학교 자연과학대학 학생들에게 한 말씀 부탁드립니다!
제가 이 질문에 대해 며칠 고민을 해봤는데, 다양한 사람들을 만나고 다양한 경험을 했으면 좋겠습니다. 공부를 열심히 하는 것도 중요하지만, 어떤 일이든 해보지 않으면 모르기 때문에, 다양한 경험을 하고 다양한 사람들을 만나면서, 학생들이 좋아하는 것을 찾아서 좋아하는 일을 할 수 있었으면 좋겠습니다.
참고문헌 및 사진 출처
1. Shaman, J., Pitzer, V. E., Viboud, C., Grenfell, B. T., & Lipsitch, M. (2010). Absolute humidity and the seasonal onset of influenza in the continental United States. PLoS Biology, 8(2), e1000316. https://doi.org/10.1371/journal.pbio.1000316
2. Stamper, A. R., Mahmud, A. S., Nuzzo, J. B., & Baker, R. E. (2025). Modeling the impact of climate extremes on seasonal influenza outbreaks across tropical and temperate locations. GeoHealth, 9, e2024GH001138. https://doi.org/10.1029/ 2024GH001138
3. Baker, R.E., Mahmud, A.S., Wagner, C.E. et al. Epidemic dynamics of respiratory syncytial virus in current and future climates. Nat Commun 10, 5512 (2019). https://doi.org/10.1038/s41467-019-13562-y
4. Park, S.W., Cobey, S., Metcalf, C.J.E., Levine, J.M., and Grenfell, B.T., Predicting pathogen mutual invasibility and co-circulation. Science, 386(6718), 175-179 (2024). DOI:10.1126/science.adq0072.
5. Nguyen-Tran H, Park SW, Vogt MR, et al. Dynamics of endemic virus re-emergence in children in the USA following the COVID-19 pandemic (2022–23): a prospective, multicentre, longitudinal, immunoepidemiological surveillance study. Lancet Infectious Diseases 2025; published online Aug 6. https://doi.org/10.1016/ S1473-3099(25)00349-4.
6. Park, S.W., Pons-Salort, M., Messacar, K., Cook, C., Meyers, L., Farrar, J., Grenfell, B.T., Epidemiological dynamics of enterovirus D68 in the United States and implications for acute flaccid myelitis. Science Translational Medicine, 13(584): eabd2400 (2021). DOI:10.1126/scitranslmed.abd2400
7. Park SW, Messacar K, Douek DC, Spaulding AB, Metcalf CJE, Grenfell BT. Predicting the impact of COVID-19 nonpharmaceutical intervention on short- and medium-term dynamics of enterovirus D68 in the US. Epidemics 2024; 46: 100736.
자연과학대학 홍보기자단 자:몽 송주형 기자 rachmaninoff@snu.ac.kr
카드뉴스는 자:몽 인스타그램 @grapefruit_snucns에서 확인할 수 있습니다.

![[2025년 9월 신임교수 인터뷰] 생명과학부 박상우 교수님을 소개합니다!](/webdata/newsroom/images/20251021/204zd87z5e6z17fzb26z302z7aczb5fz423zc30zac.png)
![[2025년 9월 신임교수 인터뷰] 화학부 이준석 교수님을 소개합니다!](/webdata/newsroom/images/20251011/52fz3b1z199z899z63czc0cz20czbc3z8a3z587za5.png)
![[2025년 9월 신임교수 인터뷰] 수리과학부 이다빈 교수님을 소개합니다!](/webdata/newsroom/images/20251007/b42z3b8zf8fzcdbz7b4z67ezbaezd29zde5z90dzb7.jpg)